细胞器稳态与疾病研究组在肿瘤干细胞研究领域取得新进展
恶性肿瘤严重威胁人类健康和生命。越来越多的证据表明,肿瘤细胞具有高度异质性(Heterogeneity)和可塑性(Plasticity)。肿瘤中的一小群具有无限增殖潜能的、能重建肿瘤发生的细胞被称作肿瘤干细胞(Cancer stem cell),又称肿瘤起始细胞(Tumour initiating cell)。肿瘤干细胞通过自我更新和分化在肿瘤中维持相对稳定的比例。肿瘤干细胞通常处于相对静止的细胞周期,对放疗和化疗药物不敏感,在某些刺激因子作用下重新进入细胞周期从而快速增殖,导致肿瘤的耐药和复发。此外,肿瘤干细胞可通过上皮-间充质转化(Epithelial-to-mesenchymal transtion)和免疫逃逸转移到远端,造成肿瘤转移。肿瘤干细胞是肿瘤发生、耐药、复发和转移的根本因素,也是导致肿瘤治疗失败的重要原因。因此寻找肿瘤干细胞特异的表面标志蛋白,将为开发靶向肿瘤干细胞的药物提供新的靶点。
近期,膜生物学国家重点实验室细胞器稳态与疾病研究组在Cancer Letters上发表研究论文LGR4 cooperates with PrPc to endow the stemness of colorectal cancer stem cells contributing to tumorigenesis and liver metastasis,报道了一个新的结直肠肿瘤干细胞特异表达膜蛋白LGR4。LGR4与正常结肠干细胞标志物LGR5同属于GPCR家族蛋白,但LGR4与LGR5的功能并不完全一致。LGR4在肝转移的结直肠肿瘤干细胞中表达升高。微组织芯片(Tissue micro-array)免疫组织化学染色和Oncomine数据库比对发现,LGR4与肿瘤干细胞转移关键蛋白PrPc表达水平正相关,因此研究人员推测LGR4可能与肿瘤的发生和转移相关。为此,研究人员从临床结直肠CD44+PrPc+肿瘤干细胞中分选出LGR4+和LGR4-亚群,并将其移植到免疫缺陷小鼠盲肠肠壁或皮下,发现LGR4+CD44+PrPc+细胞亚群比LGR4-CD44+PrPc+亚群具有更高的致瘤能力和转移能力。这些结果表明LGR4作为一个新的肿瘤干细胞表面标志蛋白,可用于富集肿瘤干细胞。
肿瘤重建(Tumor reestablishment)是肿瘤干细胞最重要的特征。为确认LGR4+CD44+PrPc+细胞是真正的肿瘤干细胞,研究人员建立了肿瘤类器官(Tumor organoid)实验体系。单个LGR4+CD44+PrPc+细胞可在Matrigel中生长出类似原代肿瘤表型特征的肿瘤类器官,原位移植单个肿瘤类器官到免疫缺陷小鼠盲肠肠壁即可成瘤。此外,LGR4+肿瘤干细胞通过自我更新和分化,在类器官和异体移植肿瘤中维持一定的比例,并产生普通肿瘤细胞(Non cancer stem cell),表明LGR4对肿瘤干细胞的干性维持和分化起到重要作用。
对肿瘤类器官进行基因编辑有助于探索单个基因对肿瘤干细胞的作用。敲低LGR4显著抑制肿瘤类器官的生长、肿瘤发生和转移,表明LGR4对于肿瘤干细胞干性维持的必要性。LGR4作为一个维持肿瘤干细胞干性的表面标志蛋白,可能是肿瘤干细胞治疗的潜在靶点,有望应用于临床抗肿瘤药物的开发。
相关研究2022年5月在线发表在Cancer Letters期刊上。中国科学院动物研究所细胞器稳态与疾病研究组杜蕾副研究员和南开大学生命科学学院陈佺教授为本文的共同通讯作者。中国科学院动物研究所博士研究生程琪,南开大学博士研究生郑浩,北京肿瘤医院李明副主任医师、王洪义副主任医师是本文的共同第一作者。该研究成果得到国家重点研发计划、国家自然科学基金等多个项目的支持。
此外,细胞器稳态与疾病研究组近期受邀在Seminars in Cancer Biology期刊发表综述文章Targeting stemness of cancer stem cells to fight colorectal cancers,阐述靶向结直肠肿瘤干细胞应用于肿瘤治疗的可行性和研究现状。中国科学院动物研究所细胞器稳态与疾病研究组杜蕾副研究员是本文的第一作者和共同通讯作者,南开大学生命科学学院陈佺教授是本文的共同通讯作者。
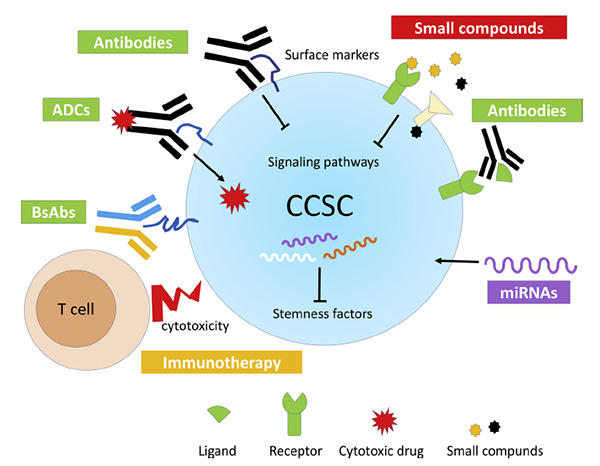
图:靶向肿瘤干细胞的策略。靶向肿瘤干细胞特异表达膜蛋白的单克隆抗体、 抗体偶联药物和双特异性单克隆抗体,靶向肿瘤干细胞特异信号通路的小分子化合物,以及靶向干性相关分子的抗体和小RNA,将有望应用于肿瘤药物的开发。
原文链接:
https://www.sciencedirect.com/science/article/pii/S0304383522002099?via%3Dihub
https://www.sciencedirect.com/science/article/pii/S1044579X21000419?via%3Dihub
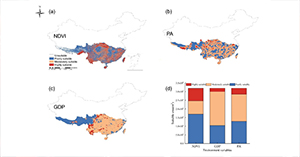
人类活动和气候变化加速生物多样性的减少,导致物种范围的转移、收缩和扩张。在全球范围内,人类活动和气候变化已对生物多样性构成了严重威胁,目前已导致全球522种灵长类动物中约68%的物种面临灭绝风险。
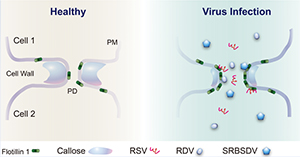
植物病毒素有“植物顽疾”之称,每年引起全球作物经济损失高达4000亿元。水稻作为人类重要的粮食作物之一,供给全世界一半以上的人口,主要种植于亚洲、非洲和南美洲等地区。

