李磊研究团队揭示皮质下母源复合体SCMC调控早期胚胎中表观重编程的新机制
卵母细胞-胚胎转变(oocyte-to-embryo transition,OET)是哺乳动物胚胎着床前发育的关键过程,标志着胚胎调控机制从依赖母源物质向依赖胚胎物质的转换,包括表观修饰重编程以及合子基因组激活(zygotic genome activation,ZGA)等多种特异生理事件在此期间发生。例如,受精后DNA甲基化大规模擦除和印记区特定维持;H3K4me3和H3K27me3等组蛋白修饰在小鼠ZGA发生的2-cell晚期从非经典向经典模式的转变等1。一般认为卵母细胞中储存的母源物质在OET过程中发挥关键作用。受研究材料和技术制约,相关领域长期进展缓慢。近期发展的微量测序及人工智能等技术为相关领域发展带来契机。2008年首次报道的卵母细胞和早期胚胎特异性表达的皮质下母源复合体SCMC(subcortical maternal complex)为揭示OET过程的分子机制提供了独特工具2。
SCMC由核心组分和非核心组分KHDC3等十多种高丰度表达的母源蛋白共同构成,主要定位于胞质并富集于皮质区。小鼠SCMC相关组分的母源敲除影响了OET过程并导致胚胎发育延迟或停滞于卵裂期。在人类中,SCMC相关基因突变与多种生殖障碍高度相关,包括受精失败、早期胚胎停育、复发性流产及葡萄胎等。SCMC已成为哺乳动物早期胚胎母源调控和人类女性生殖医学研究的热点和新方向1。近期SCMC研究取得系列重要进展,四川大学华西第二医院邓东教授团队联合中国科学院动物研究所李磊研究员团队,利用冷冻电镜技术成功解析了小鼠和人类SCMC核心复合体(SCMCcore)的三维结构,并揭示SCMC通过稳定14-3-3蛋白调控小鼠早期胚胎的细胞周期;这些研究为理解hSCMC突变导致胚胎发育停滞等女性生殖疾病的发病机制提供了重要线索3-5。值得注意的是,大量病例报道人类SCMC组分突变导致早期胚胎或卵母细胞母源印记区域DNA甲基化的异常,提示SCMC参与表观修饰调控。然而,目前对于“胞质定位的SCMC如何调控细胞核内表观修饰事件”这一关键科学问题,仍缺乏明确的分子机制解释。
2025年4月17日,中国科学院动物研究所李磊研究员联合广州医科大学附属第三医院高征、清华大学颉伟教授以及四川大学华西第二医院邓东教授等团队,在《Nature Structural & Molecular Biology》发表了题为"The subcortical maternal complex safeguards mouse oocyte-to-embryo transition by preventing nuclear entry of SPIN1"的重要研究成果。该研究首次揭示SCMC组分KHDC3通过维持表观调控因子SPIN1的胞质定位,确保小鼠OET过程中H3K4me3重编程和ZGA的正常进行。这一发现不仅阐明了SCMC调控早期胚胎发育的新机制,凸显了母源蛋白的定位改变在胚胎表观修饰重塑等重要生物学事件中的意义,也为人类SCMC突变导致生殖疾病的研究提供了重要理论参考。
研究团队通过整合多组mSCMC免疫沉淀-质谱数据,鉴定出SCMC复合物的新成员SPIN1。已有的研究表明SPIN1在普通细胞系中主要定位于细胞核,并与H3K4me3修饰高度结合调控基因表达,但在小鼠卵母细胞和早期胚胎中该蛋白主要呈现胞质定位。研究团队通过系统的生物化学实验,证实这种定位模式是由SPIN1与KHDC3的C端无序区直接相互作用实现的。结合Alphafold3的蛋白结构预测,研究者重建了SCMCcore- KHDC3/SPIN1的蛋白结构模型,揭示了该复合物的分子互作基础。
借助基因敲除小鼠模型,研究人员发现在母源KHDC3缺失以及SCMCcore敲除的卵母细胞和早期胚胎中SPIN1表达水平显著下调,并伴随其异常核定位。免疫荧光染色证实,异常入核的SPIN1可与H3K4me3结合共定位于染色体上。通过显微注射技术,在受精卵中表达带有核定位信号的SPIN1,研究人员成功模拟了SPIN1的异常入核现象,并发现该过程以剂量依赖的方式损害胚胎发育及H3K4me3重编程。利用STAR ChIP-seq等测序技术,研究者在过表达入核SPIN1和KHDC3母源敲除的晚期2-cell胚胎中,进一步观察到明显的H3K4me3重编程受阻。分子机制上,SPIN1与H3K4me3的高亲和力结合阻碍了KDM5B去甲基化酶对H3K4me3的识别,从而干扰正常的组蛋白去甲基化。更重要的是,使用抑制剂阻断SPIN1与H3K4me3的结合能够部分挽救KHDC3缺失胚胎的发育缺陷。总之,该研究揭示了胞质定位的KHDC3通过调控具有表观修饰调控功能的SPIN1定位,在OET过程中发挥"分子门控"作用,确保H3K4me3重编程和ZGA的正常进行。这一发现为理解母源-合子转换的表观遗传调控机制提供了全新视角。
中国科学院动物研究所李磊研究员、广州医科大学附属第三医院高征助理研究员、清华大学颉伟教授和四川大学华西第二医院邓东教授为该研究的共同通讯作者;中国科学院动物研究所博士生徐承鹏、博士后秦丹丹、山东大学卢绪坤博士和四川大学华西第二医院博士生齐倩倩为共同第一作者;中国科学院动物研究所的博士生武雨和王琪智、聂小庆博士以及四川大学华西第二医院的韩卓博士、江咏梅主任也做出了重要贡献。该研究得到国家自然科学基金、国家重点研发计划、新基石项目、广东省自然基金及辉凌项目的资助。
原文链接:https://www.nature.com/articles/s41594-025-01538-0
参考文献:1-5
1 Lu,X.,Gao,Z.,Qin,D. & Li,L. A Maternal Functional Module in the Mammalian Oocyte-To-Embryo Transition. Trends Mol Med 23,1014-1023 (2017). https://doi.org/10.1016/j.molmed.2017.09.004Li,L.,Baibakov,B. & Dean,J.
2 A subcortical maternal complex essential for preimplantation mouse embryogenesis. Dev Cell 15,416-425 (2008). https://doi.org/10.1016/j.devcel.2008.07.010
3 Chi,P. et al. Cryo-EM structure of the human subcortical maternal complex and the associated discovery of infertility-associated variants. Nature structural & molecular biology 31,1798-1807 (2024). https://doi.org/10.1038/s41594-024-01396-2
4 Chi,P. et al. Structural basis of the subcortical maternal complex and its implications in reproductive disorders. Nature structural & molecular biology 31,115-124 (2024). https://doi.org/10.1038/s41594-023-01153-x
5 Han,Z. et al. The subcortical maternal complex modulates the cell cycle during early mammalian embryogenesis via 14-3-3. Nature communications 15,8887 (2024). https://doi.org/10.1038/s41467-024-53277-3

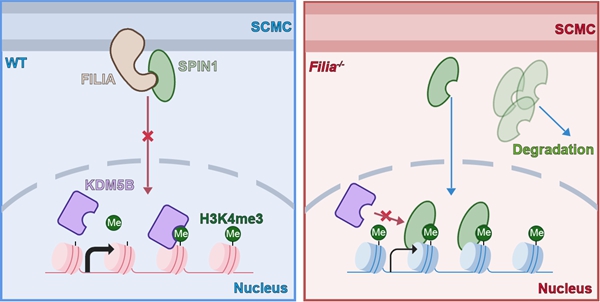
本研究的模式图
环形RNA是一类具有特殊环状结构的RNA分子,其独特的闭合结构可抵抗核酸外切酶降解,相较于线性RNA更加稳定。近年来,大量研究表明环形RNA在基因表达调控、生物发育及疾病发生过程中发挥着重要作用,有望成为多种...
低遗传多样性物种如何长期续存,一直是保护生物学关注的热点问题。雪豹(Panthera uncia)是青藏高原及周边山脉高原生态系统的濒危旗舰物种,其分布范围涉及亚洲12个国家,是全球栖息地海拔最高的大型猫科动物。...
生物的地理分布格局是宏观生态学关注的热点问题之一。受到面积、能量、时间等的影响,低纬度热带地区的生物多样性通常高于中、高纬度地区,被称为纬度梯度多样性分布模式。

