王震波研究组合作绘制卵母细胞纺锤体的蛋白图谱并揭示Ccdc69调控纺锤体组装的机制
卵母细胞减数分裂涉及两次染色体分离与胞质分裂,最终形成单倍体配子,在此过程中,正确组装并稳定发挥功能的纺锤体保证了染色体的精确分离与细胞分裂进程[1]。减数分裂纺锤体的组装与功能受定位于纺锤体及其附近区域的蛋白质调控。目前已有较多对于小鼠减数分裂各时期卵母细胞的蛋白质组学研究[2-4],然而,卵母细胞的体积较大,纺锤体处蛋白可能被高丰度的胞质蛋白信号掩盖,同时由于取样困难,对于卵母细胞减数分裂纺锤体的蛋白质组研究几乎空白。
2025年7月30日,中国科学院动物研究所王震波研究员、韩之明副研究员与中国医学科学院北京协和医学院黄超兰教授团队合作,在《Cellular and Molecular Life Sciences》发表了题为Proteome of oocyte spindle identifies Ccdc69 regulates spindle assembly like “band-tightening spell”的研究论文。该研究首次获取并分析了小鼠卵母细胞第一次减数分裂中期与第二次减数分裂中期纺锤体的蛋白质组学数据,为研究卵母细胞减数分裂纺锤体功能调控提供了新的思路,并发现了Ccdc69蛋白以类似“紧箍咒”的方式,参与调控小鼠卵母细胞减数分裂纺锤体的组装和功能。
研究首先通过显微操作技术,分别抽取卵母细胞第一次减数分裂中期(MI)与第二次减数分裂中期(MII)的纺锤体-染色体复合物,通过微量蛋白质谱技术,总共鉴定到1817个蛋白,其中有部分蛋白如Tacc3、Aurka、Ndc80等已被证实参与调控纺锤体组装。575个蛋白仅在MI纺锤体中被检测到,而227个蛋白仅在MII纺锤体中可被检测,暗示这些蛋白可能在减数分裂不同时期中发挥特殊功能。MI和MII纺锤体的共有蛋白有1015个,其中差异表达蛋白共有201个,研究团队通过GO分析将这些蛋白进行再次分类,绘制卵母细胞减数分裂纺锤体的蛋白质组图谱,为深入了解减数分裂纺锤体组装与功能调控,第一次减数分裂与第二次减数分裂的差异,卵母细胞减数分裂进程调控的分子机制研究提供新思路,并为卵母细胞发育异常等临床疾病研究提供潜在靶点。
在该蛋白组图谱中,研究团队发现了一个新的参与卵母细胞减数分裂纺锤体组装的蛋白Ccdc69。结果显示,Ccdc69基因敲除雌性小鼠的生育力与卵母细胞成熟不受影响,但其MI期卵母细胞纺锤体变长,而在野生型卵母细胞中过表达Ccdc69会使纺锤体缩短、第一极体排出率下降,且具有明显的剂量效应,说明Ccdc69参与调控纺锤体组装和减数分裂进程。进一步研究发现,Ccdc69是一个微管相关蛋白,通过影响Ran蛋白表达量从而调控微管的生成,而适量的Ccdc69调控Aurka、Tpx2、Tacc3等蛋白保证了aMTOC的正确分布与双极纺锤体的形成。同时,过量的Ccdc69会导致动粒微管连接紊乱并异常激活SAC活性,延迟减数分裂进程。蛋白截短实验证明C端的两个coiled-coin结构域负责维持Ccdc69的稳定与功能。研究人员发现Ccdc69包裹在纺锤体外侧,对纺锤体组装的调控宛如《西游记》中的紧箍咒,不念咒时孙悟空行动如常,咒语越多,限制越大;在Ccdc69缺失时,纺锤体的组装与功能较为正常,而Ccdc69的含量逐渐上升,会加重干扰微管生成与aMTOC的分布,限制纺锤体的伸长。
中国科学院动物研究所王震波研究员、韩之明副研究员和中国医学科学院北京协和医学院黄超兰教授为该研究的通讯作者;中国科学院动物研究所博士生郭佳妮、中国医学科学院北京协和医学院已毕业博士朱柳为共同第一作者;广东省第二人民医院生殖中心的孟铁刚研究员,中国科学院动物研究所博士生孙思敏、杨雪梅、赵丙旺、鲁宜珂、徐源鸿、已毕业硕士张颐娜和已毕业博士岳巍对本研究也做出了重要贡献。该研究得到国家重点研发计划、国家自然科学基金、中国医学科学院北京协和医学院医学科学创新基金的资助。感谢器官再生与智造全国重点实验室提供的技术平台与资源保障。
原文链接:https://link.springer.com/article/10.1007/s00018-025-05821-7
1. Dumont J,Desai A. Acentrosomal spindle assembly and chromosome segregation during oocyte meiosis. Trends in Cell Biology. 2012;22: 241-9.
2. Cao S,Huang S,Guo Y,Zhou L,Lu Y,Lai S. Proteomic‐based identification of oocyte maturation‐related proteins in mouse germinal vesicle oocytes. Reproduction in Domestic Animals. 2020;55: 1607-18.
3. Sun H,Sun G,Zhang H,An H,Guo Y,Ge J,et al. Proteomic Profiling Reveals the Molecular Control of Oocyte Maturation. Molecular & Cellular Proteomics. 2023;22.
4. Jiang Y-R,Zhu L,Cao L-R,Wu Q,Chen J-B,Wang Y,et al. Simultaneous deep transcriptome and proteome profiling in a single mouse oocyte. Cell Reports. 2023;42.
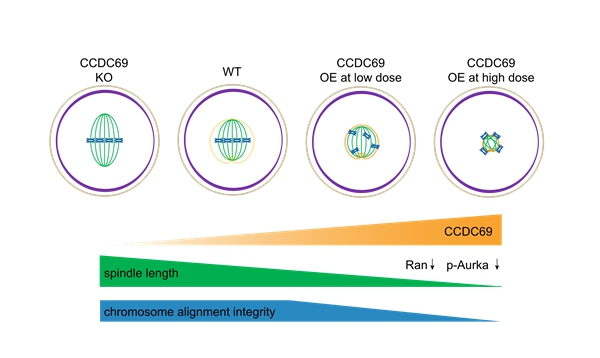
图1 Ccdc69调控纺锤体伸长的“紧箍咒”模型示意图
衰老,作为一项涉及多器官、跨越多重生物学层级的机体系统性退行性演变,其深层的分子机制至今仍是生命科学领域悬而未决的核心命题。在人类漫长的生命周期中,一个根本性问题在于:各器官系统是否遵循统一的衰...
辐射式演化是生物多样性形成的重要过程之一。作为适应辐射(Adaptive Radiation)的经典案例,加拉帕格斯群岛的达尔文雀或东非的慈鲷等类群受生态位分化驱动的快速物种形成过程为人熟知。
在哺乳动物发育过程中,成熟单倍体配子的形成起始于原始生殖细胞(Primordial Germ Cells, PGCs)的谱系发育。以小鼠为模型的研究表明,PGCs从胚胎期形成,历经迁移至生殖嵴直至完成性别分化的整个过程中,始终维...

