王金勇研究组合作开发脐血CD34干祖细胞诱导来源iNK/CAR-iNK工程化制备技术
自然杀伤(NK)细胞作为一种固有免疫细胞,针对衰老、病毒感染、癌变等异常细胞具有广谱免疫监视和清除功能。嵌合抗原受体(CAR)工程化的CAR-NK细胞,还获得类似CAR-T细胞的精准靶向杀伤功能,显著提升对特定抗原阳性细胞的清除效率。来自基础和临床的研究数据表明,NK/CAR-NK细胞副作用较小,但在持久疗效方面尚需优化增强。在适合用CAR-T细胞疗法的患者人群中,因为价格昂贵和制备等待时间等因素,只有低于10%的适用患者能够用上商业化的CAR-T产品。因此,开发货架式(off-the-shelf)、价廉的NK/CAR-NK细胞制剂,有望提高免疫细胞治疗的可及性和普及性,造福众多患者。当前,临床使用的CAR-NK细胞主要来自工程化的外周血或脐带血等人体组织分离扩增的成熟NK细胞,但在成熟NK阶段进行CAR工程化引入高昂成本。将CAR工程化节点前移至造血干祖细胞(CD34+ HSPC)阶段,结合CD34+ HSPC增殖和NK谱系定向诱导分化,有望大幅降低CAR工程化成本。
2025年10月7日,Nature Biomedical Engineering杂志在线发表了由中国科学院动物研究所、北京干细胞与再生医学研究院王金勇研究组题为Large-scale generation of iNK and CAR-iNK cells from CD34+ hematopoietic stem and progenitor cells for adoptive immunotherapy的研究论文(图1)。在该研究中,科研人员整合了CD34造血干祖细胞 CAR工程化、干细胞扩增和NK谱系定向诱导技术,成功建立了高效诱导脐带血造血干祖细胞(CD34+ HSPCs)体外产生iNK(induced NK)细胞及CD19 CAR-iNK细胞的工艺制备体系。经过42天的诱导,实现了将单个CD34+ HSPCs诱导输出107级别的iNK细胞或106级别的CD19 CAR-iNK细胞。
该方法由三个步骤组成,CD34+ HSPCs或转导CD19 CAR的CD34+ HSPCs(CD19 CAR-HSPCs)扩增(第0-14天)、通过类器官聚集体诱导获得iNK或CAR-iNK细胞(第14-28天)、以及iNK或CAR-iNK细胞的成熟和大规模扩增(第28-42天)(图2)。具体为第一步利用辐照灭活后的AFT024细胞扩增CD34+ HSPCs或CD19 CAR-HSPCs,经过两轮共计14天的扩增,可将1.0 × 106个CD34+ HSPCs扩增获得1.1 × 109 ± 0.2 × 109个CD34+ HSPCs或1.0 × 109 ± 0.1 × 109个CD19 CAR-HSPCs,在扩增的CD34+ HSPCs中,CD34+细胞比例为71.9% ± 4.7%(数据来源于三份脐带血样品)。在CD19 CAR-HSPCs中,CD34+细胞比例为61.0% ± 2.4%(数据来源于三份脐带血样品)。第二步将扩增后的HSPCs或CD19 CAR-HSPCs与环境滋养细胞混合制备类器官,向NK细胞谱系定向诱导分化。本研究中,作者使用三份脐血扩增的HSPCs或CD19 CAR-HSPCs分别制备了50个类器官,每个类器官含有1.0 × 104个HSPCs或CD19 CAR-HSPCs,在诱导14天后,利用HSPCs或CD19 CAR-HSPCs制备的类器官均收获了1.2 × 108 ± 0.2 × 108 个CD45+细胞。第三步将收获的CD45+细胞进行NK成熟化和增殖。经过14天的诱导,HSPCs制备的50个类器官最终收获了6.4 × 109 ± 0.6 × 109个iNK细胞,CD45+CD3-CD56+细胞的比例达到了99.6% ±0.0%,CD19 CAR-HSPCs制备的50个类器官最终收获了5.6 × 109 ± 0.3 × 109个iNK细胞,CD56的表达比例达到99.5% ±0.3%,CD19 CAR的表达比例达到62.3% ± 3.3%。CD16在iNK细胞或CD19 CAR-iNK细胞中的表达比例是37.4%-69.4%。表明本诱导方法获得的iNK细胞成熟程度高。经统计,单个CD34+ HSPCs诱导可获得1.4 × 107 ± 0.1 × 107 iNK或7.6 × 106 ± 1.2 × 106个CD19 CAR-iNK细胞。值得注意的是,这些iNK或CD19 CAR-iNK细胞继续培养7天后,可以进一步增殖,CD16在iNK细胞中的表达比例可达到67.8% ± 3.4%,在CD19 CAR-iNK细胞中的表达比例可达到53.5% ± 6.2%。CD19 CAR在CD19 CAR-iNK细胞中的表达依然稳定,比例为62.9% ± 5.7%。经过49天的诱导周期后,单个CD34+ HSPCs可获得8.3 × 107 ± 0.7 × 107个iNK细胞或3.2 × 107 ± 0.2 × 107个CD19 CAR-iNK细胞。通过本诱导工艺,理论上可将1/5份脐带血(约1.0 × 106个CD34+ HSPCs)诱导获得1.4 × 1013 - 8.3 × 1013个iNK细胞或7.6 × 1012 - 3.2 × 1013 个CAR-iNK细胞。按照每剂次注射109-1010个细胞算,可以注射760到83000剂次。更重要的是,该诱导方法大幅度节省了CD19 CAR工程化成本,CD34+ CAR HSPCs细胞诱导获得CD19 CAR-iNK细胞的病毒使用量是利用成熟NK细胞制备CD19 CAR-NK细胞的病毒使用量的1/140000(诱导42天)到1/600000(诱导49天)。
在体内外抗肿瘤实验中,iNK细胞的肿瘤杀伤能力与同一份脐血扩增的成熟NK细胞相似。同样,CD19 CAR-iNK细胞的特异性杀伤能力与同一份脐血成熟NK细胞制备的CD19 CAR-UCB-NK细胞也相似。CD19 CAR-iNK细胞在CDX(人源肿瘤细胞系异种移植)模型和PDX(病人来源肿瘤异种移植)模型中均展现了良好的体内抗肿瘤能力,并显著延长肿瘤负荷鼠的生存期。
综上,该研究开发了将脐带血来源的造血干祖细胞高效诱导为iNK细胞或CAR-iNK细胞的制备工艺。相比已报道的方法,该方法可以显著提高iNK细胞或CAR-iNK细胞的诱导效率,并显著降低制备CAR-NK细胞的病毒使用量。解决了CAR-NK临床转化中“数量不足、价格高昂”的核心瓶颈,为普惠化的CAR-iNK免疫治疗奠定了关键技术基础。
中国科学院动物研究所器官再生与智造全国重点实验室、北京干细胞与再生医学研究院王金勇研究员、张梦云副研究员和中国医学科学院血液病医院(中国医学科学院血液学研究所)血液与健康全国重点实验室竺晓凡教授为该论文的共同通讯作者。北京干细胞与再生医学研究院胡房晓副研究员,中国科学院广州生物医药与健康研究院李剑焕博士、王瑶博士后,中国科学院动物研究所林云轻博士生和中国医学科学院血液病医院(中国医学科学院血液学研究所)章婧嫽博士为该研究的共同第一作者。该研究在科技部国家重点研发计划(2024YFA1108302,2020YFA0112404),国家基金委自然科学基金(82450001,81925002,82300132)和国家卫健委四大慢病重大专项(No. 2023ZD0501200)等项目支持下完成。
原文链接:https://www.nature.com/articles/s41551-025-01522-5

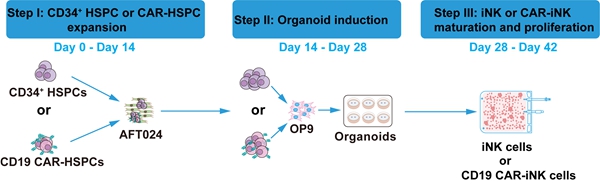
图:脐带血来源iNK/CAR-iNK工程化制备技术
荧光标记技术与显微成像的结合极大推动了生命科学研究的进展。绿色荧光蛋白(GFP)等标签已被广泛用于蛋白质成像,然而其“常亮”特性限制了在亚细胞尺度上对特定分子群体进行精确追踪。为了突破这一局限,研究人...
环形RNA因其独特的共价闭合环状结构,能够有效抵抗细胞内核酸外切酶的降解,展现出远高于线性RNA的稳定性,不仅成为基因调控与疾病机制研究的前沿热点,也作为多种重大疾病的生物标志物与潜在治疗靶点而备受关注。

